Buenos días queridos amigos, en esta oportunidad queremos regalarles la mejor información para que puedan comprender sobre que diferencias existen entre los enlaces covalentes y los enlaces iónicos. A continuación les contaremos que son los enlaces covalentes, que son los enlaces iónicos, que características tiene cada uno y cuales son las diferencias que tienen. Tambien les mostraremos imágenes con cuadros comparativos que complementan la información y los ayudaran a comprender mejor estos conceptos.
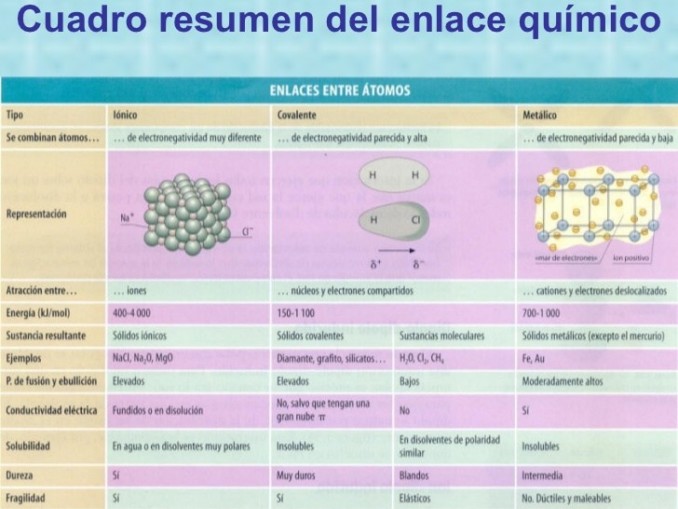
Imagen con cuadro comparativo entre los diferentes enlaces entre átomos que existen.
¿Qué son los enlaces?
Una molécula o compuesto se forma cuando dos o más átomos forman un enlace químico, uniéndolos. Los dos tipos de enlaces que existen son enlaces iónicos y enlaces covalentes. La distinción entre ellos tiene que ver con la forma en que los átomos que participan en el enlace comparten sus electrones.
¿Qué es un enlace iónico?
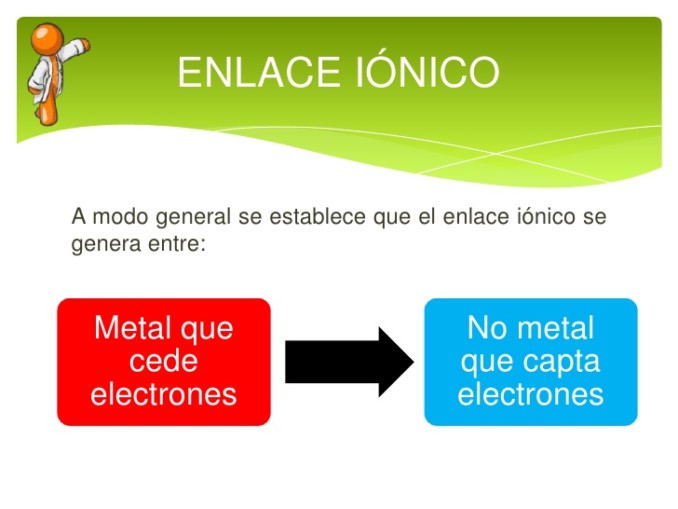
En un enlace iónico, un átomo dona esencialmente un electrón para estabilizar el otro átomo con el que se esta uniendo. Los átomos que participan en un enlace iónico tienen diferentes valores de electronegatividad entre sí. Un enlace polar está formado por la atracción entre iones de carga opuesta. Puede predecir que se formará un enlace iónico cuando dos átomos tengan diferentes valores de electronegatividad y detecten un compuesto iónico por sus propiedades, incluida la tendencia a disociarse en iones en el agua.
¿Qué es un enlace covalente?
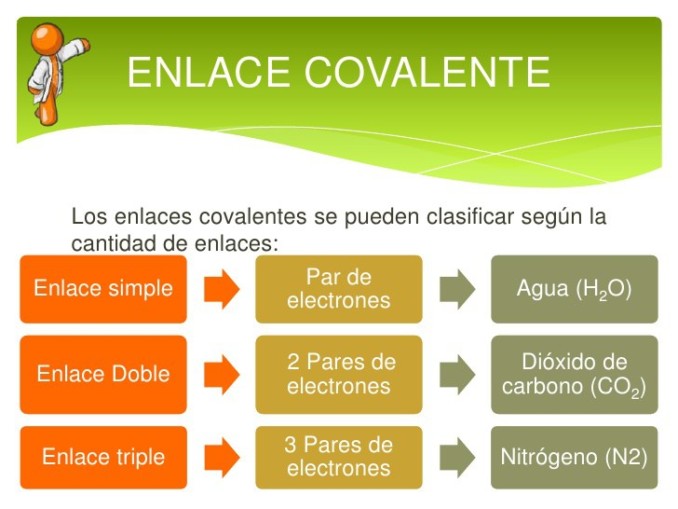
En un enlace covalente, los átomos están unidos por electrones compartidos. En un enlace covalente verdadero, los valores de electronegatividad son los mismos, aunque en la práctica los valores de electronegatividad solo necesitan estar cerca. Si el electrón se comparte por igual entre los átomos que forman un enlace covalente, entonces se dice que el enlace es no polar. Por lo general, un electrón se siente más atraído por un átomo que por otro, formando un enlace covalente polar. Por ejemplo, los átomos en agua, H2O, se mantienen unidos por enlaces covalentes polares. Puedes predecir que se formará un enlace covalente entre dos átomos no metálicos. Además, los compuestos covalentes pueden disolverse en agua, pero no se disocian en iones.
¿Qué diferencias existen entre enlaces covalentes y enlaces iónicos?
Existen dos tipos de enlaces atómicos entre los que encontramos a los enlaces iónicos y enlaces covalentes. Se diferencian entre si en cuanto a su estructura y a sus propiedades. Se forma un enlace covalente cuando hay una unión entre dos elementos no metálicos. Los electrones se comparten entre los dos átomos para que puedan alcanzar una capa exterior completa. Los compuestos covalentes no conducen electricidad. Un enlace iónico se forma entre un mental y un no metal, entre moleculas que consisten en iones cargados. Estos iones tienen cargas opuestas (tanto negativas como positivas). Los compuestos iónicos conducen la electricidad cuando se disuelven.
Las moléculas de un compuesto iónico están unidas por la atracción eléctrica de los dos o más iones. Estos iones pueden ser de dos tipos catión el que tiene carga positiva o anión el que tiene carga negativa. Los cationes son generalmente metales, mientras que los aniones generalmente son no metales o poliatómicos. Por otro lado, un compuesto covalente generalmente se forma cuando dos elementos no metálicos se unen. En este tipo de compuesto, los electrones se comparten y no se transfieren, y esto causa el vínculo entre ellos.
Los compuestos iónicos tienen un alto punto de fusión y ebullición, mientras que los compuestos covalentes tienen un punto de fusión y punto de ebullición comparativamente más bajo. La razón de este hecho es que los compuestos iónicos requieren una gran cantidad de energía para romper sus enlaces iónicos y separar las cargas positivas y negativas. Los compuestos covalentes se separan mucho más fácilmente, porque se forman a partir de moléculas distintas que no interactúan entre sí.
Los enlaces de los compuestos iónicos son más cristalinos que los enlaces del compuesto covalente. Por lo tanto, los compuestos covalentes son más suaves y más flexibles. Los compuestos covalentes también son más inflamables que los compuestos iónicos, debido a que a menudo contienen carbono e hidrógeno.
Los compuestos iónicos ayudan a conducir la electricidad en el agua, ya que son portadores de carga. Los compuestos covalentes no tienen esta capacidad porque no contienen iones. Los compuestos iónicos también son más solubles en agua que los compuestos covalentes. Esto se debe a que el agua disuelve las sustancias polares, que es la consistencia del compuesto iónico, mientras que los compuestos covalentes son no polares.
Cuadros comparativos entre enlaces covalentes y enlaces iónicos
Aquí les dejamos las mejores imágenes con cuadros comparativos sobre los diferentes enlaces que existen, para que puedan comprender de manera mejor todo lo explicado en este blog.
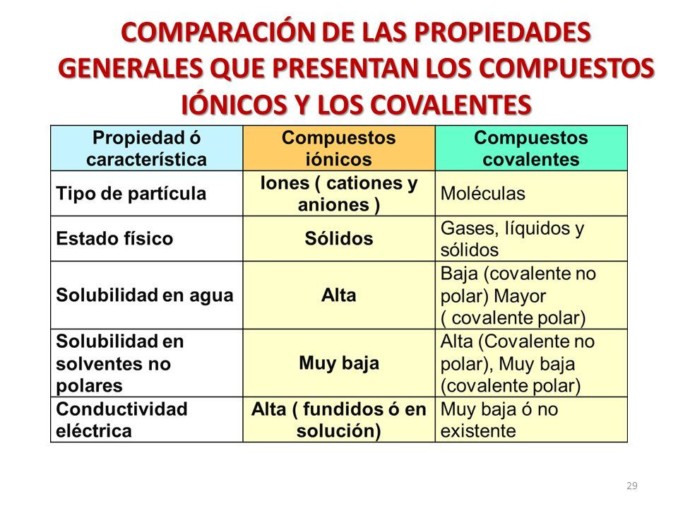
Imagen con cuadro comparativo con características y propiedades de los diferentes enlaces.
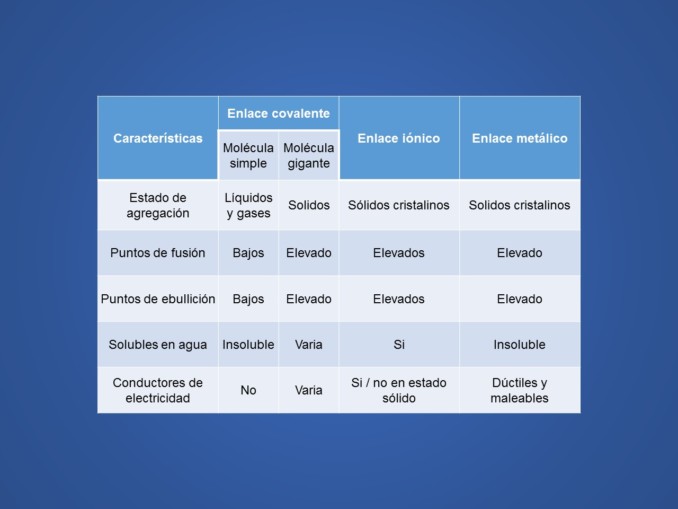

Información sobre enlace iónico y enlace covalente.
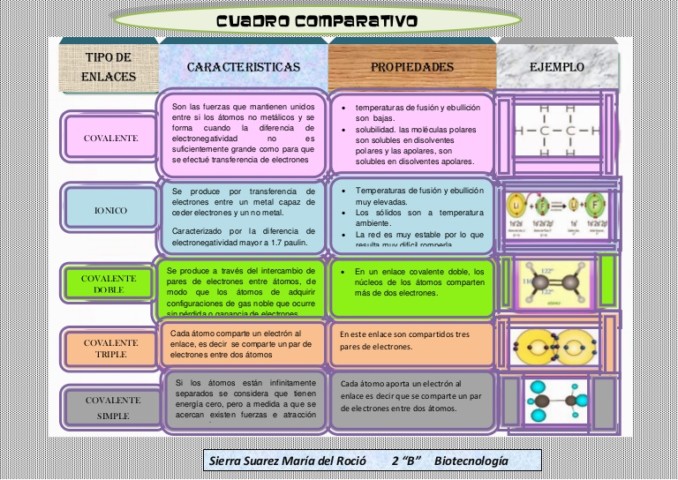
Características, propiedades y ejemplos: enlaces covalentes y enlaces iónicos.
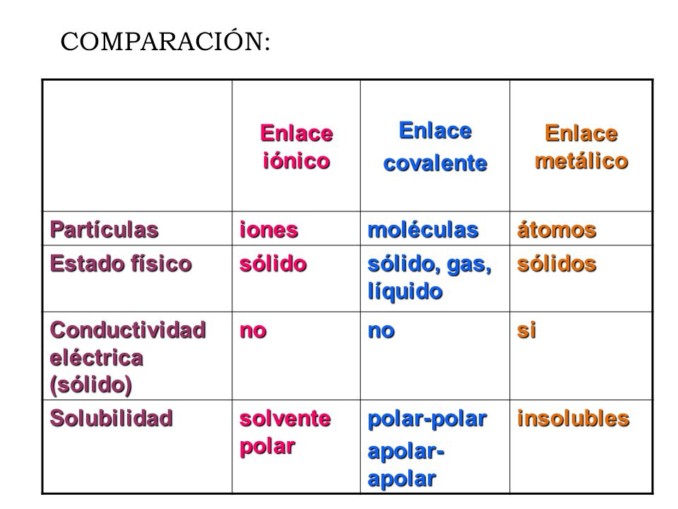

Cuadro comparativo con los diferentes enlaces entre átomos que existen.
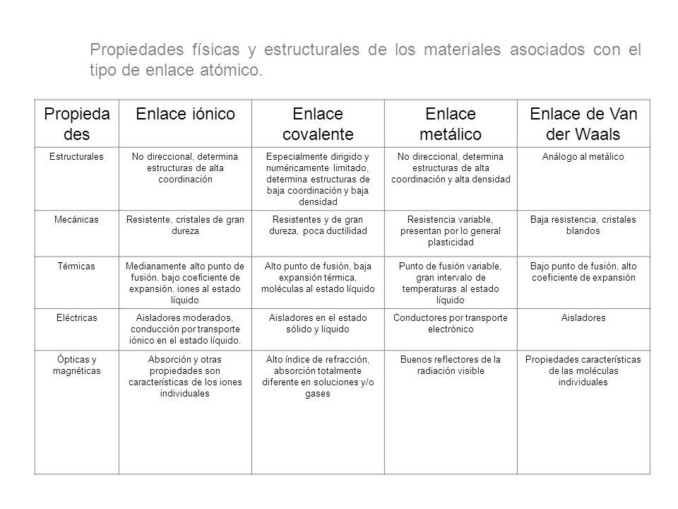
Cuadro comparativo entre enlace covalente y enlace iónico: propiedades de cada uno de los enlaces.
No olvides dejar tu comentario acerca de lo explicado en este blog y de las imágenes con los cuadros comparativos que les mostramos…