Ácidos y bases
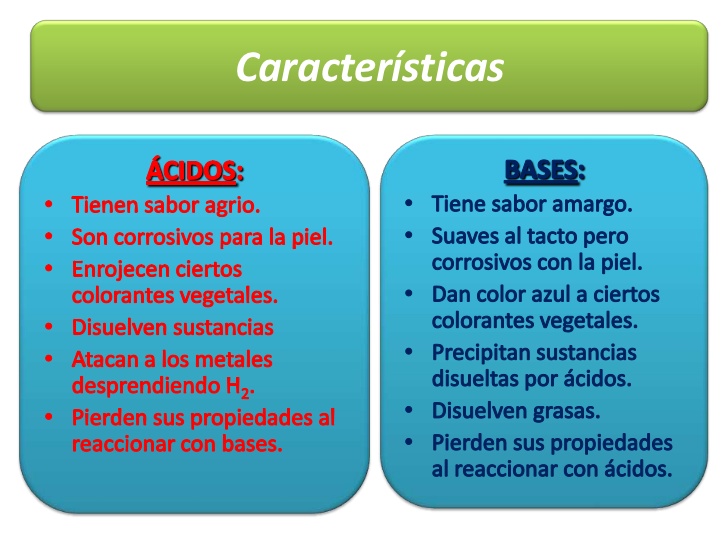
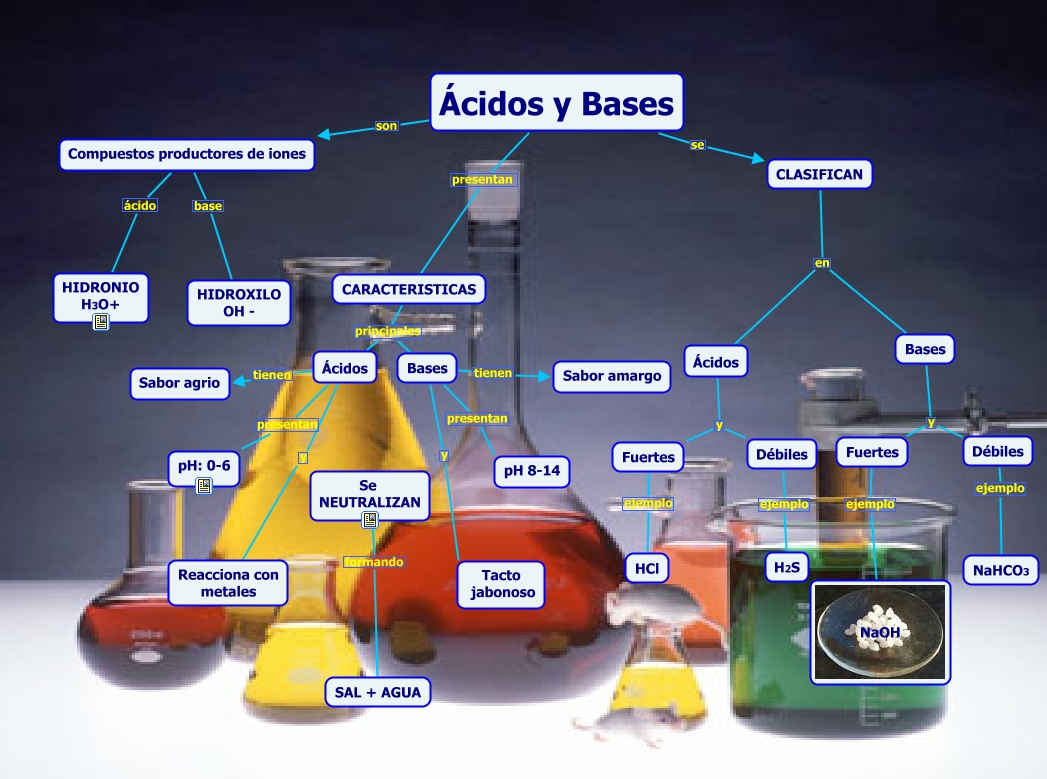
Son dos tipos de compuestos químicos que presentan características opuestas. Los ácidos tienen un sabor agrio, colorean de rojo el tornasol (tinte rosa que se obtiene de determinados líquenes) y reaccionan con ciertos metales desprendiendo hidrógeno. Las bases tienen sabor amargo, colorean el tornasol de azul y tienen tacto jabonoso. Cuando se combina una disolución acuosa de un ácido con otra de una base, tiene lugar una reacción de neutralización. Esta reacción en la que, generalmente, se forman agua y sal, es muy rápida. Así, el ácido sulfúrico y el hidróxido de sodio NaOH, producen agua y sulfato de sodio.
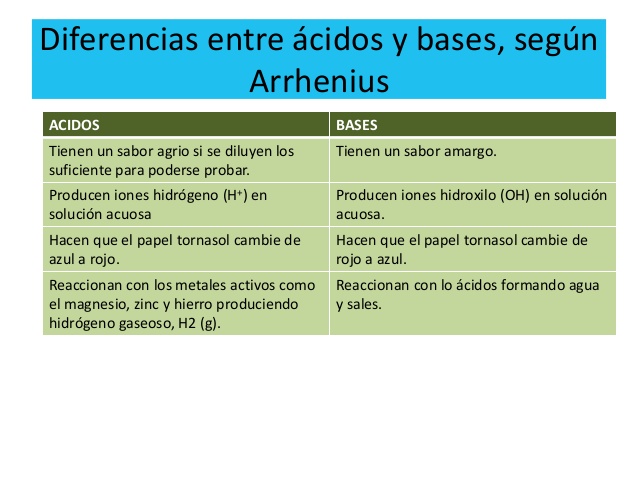
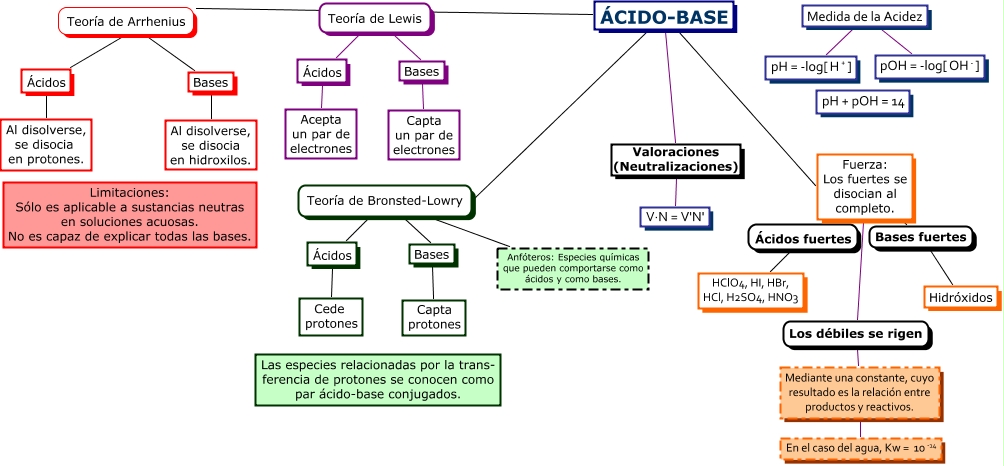
Diferencias entre ácidos y bases:
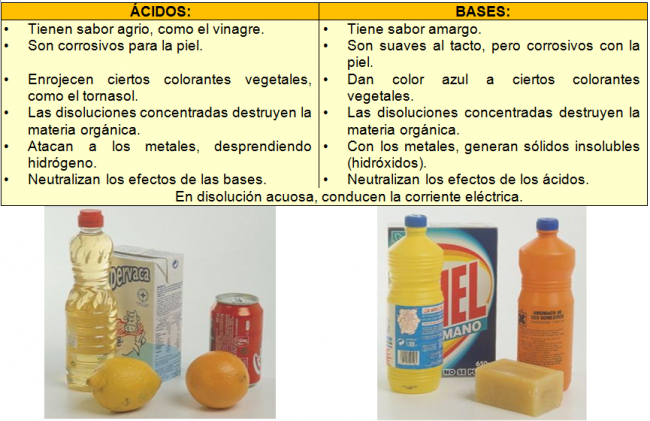
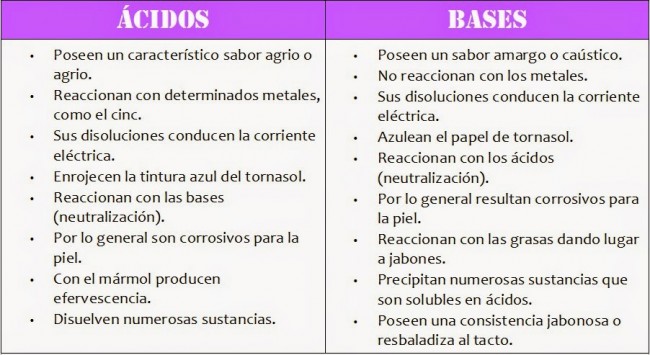
 Cuadros comparativos entre ácidos y bases:
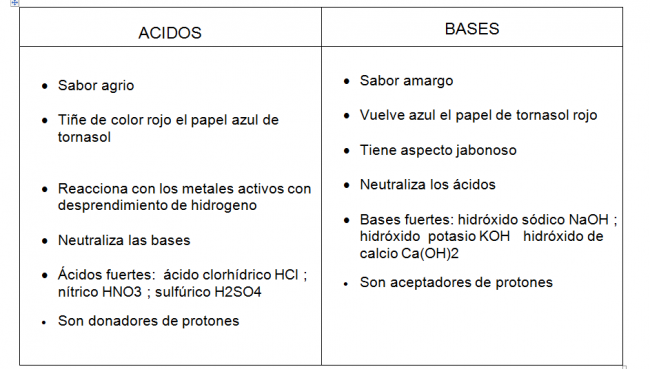
Cuadros comparativos entre ácidos y bases:
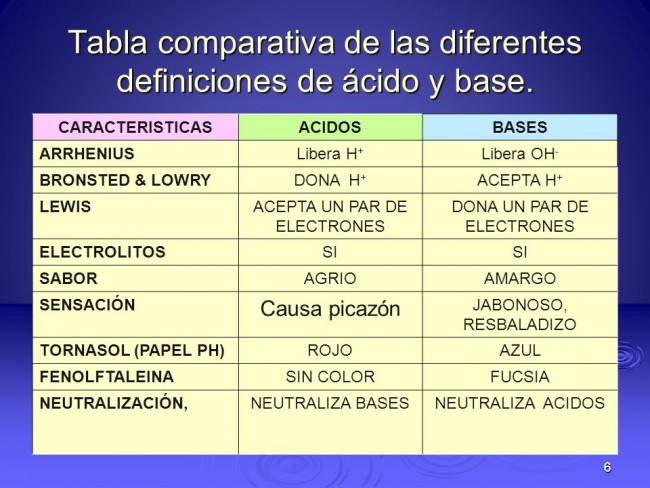
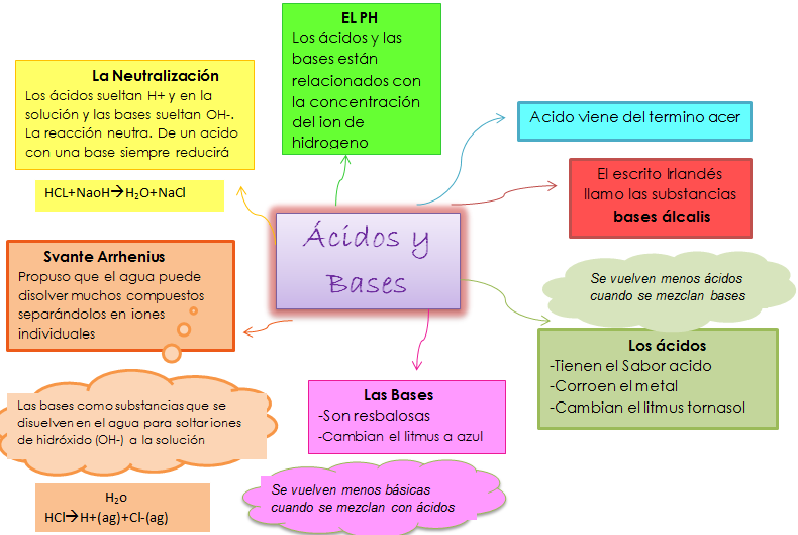
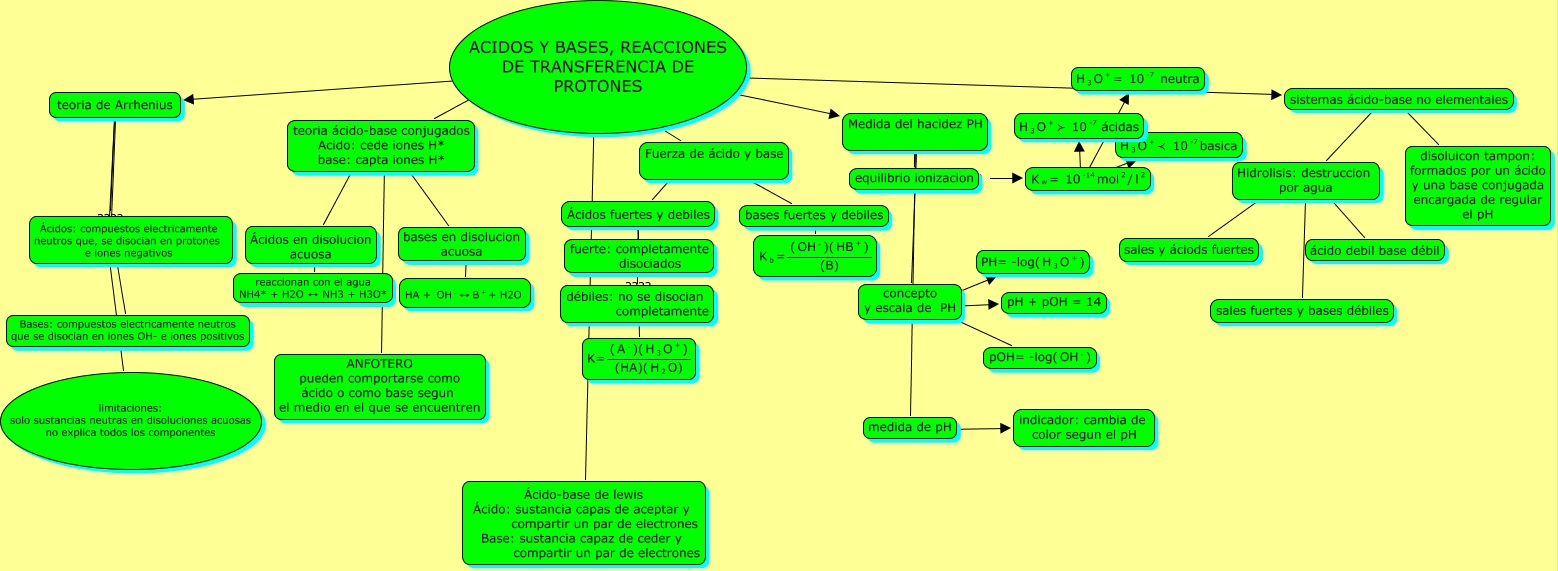
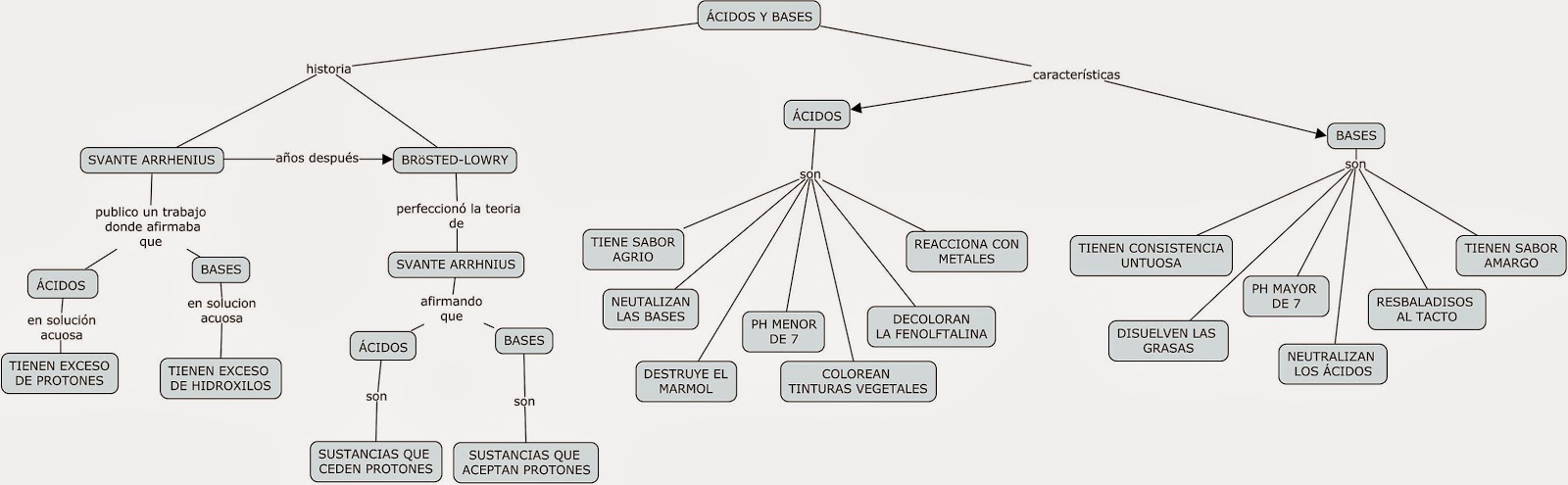
Los conocimientos modernos de los ácidos y las bases parten de 1834, cuando el físico inglés Michael Faraday descubrió que ácidos, bases y sales eran electrólitos por lo que, disueltos en agua se disocian en partículas con carga o iones que pueden conducir la corriente eléctrica. En 1884, el químico sueco Svante Arrhenius (y más tarde el químico alemán Wilhelm Ostwald) definió los ácidos como sustancias químicas que contenían hidrógeno, y que disueltas en agua producían una concentración de iones hidrógeno o protones, mayor que la existente en el agua pura.
Cuadro sinóptico de ácidos y bases:
Ejemplos de ácidos y bases:
Ácidos: Ácido nítrico, acido cítrico, ácido sulfúrico. ácido fórmico, ácido perclórico, etc.
Bases: Amoníaco, Bicarbonato de sodio, hipoclorito de sodio , etc.
¿Te sirvieron estos cuadros conceptuales? Deja tu comentario