Los estados de la materia dan cuenta de nuestro mundo, pero también de lo que puede llegar a ser la realidad más allá de la intuición que tengamos de ella. A continuación, como en ningún otro sitio, presentamos cuadros sinópticos de los estados de la materia con información y clasificaciones.
¿Cuáles son los estados de la materia?
Los estados de la materia son las diversas formas en que se presenta la materia en el universo. Se conocen como estados de agregación de la materia también, ya que las partículas presentan diferentes agrupamientos de acuerdo al estado. Por supuesto, los estados de la materia actuales no son los mismos que los clásicos, aquellos que el ser humano simplemente necesitaba de la empiria para analizarlos.
Podemos hablar de cuatro estados de la materia fundamentales. Los primeros tres conocidos desde que la ciencia da sus primeros pasos (e incluso antes): sólido, gaseoso y líquido. El cuarto, bastante posterior, ya que es el estado plasmático e implica cierto desarrollo de la técnica y la experimentación.
Sin embargo, esta clasificación en la actualidad se ha extendido lo bastante. Por ejemplo, hay algunos que se presentan en condiciones extremas, inducidas en el laboratorio: el condensado de Bose-Einstein (BEC); el condensado de Fermi y el supersólido.
Las características de los estados de la materia dependen de la fuerza de atracción de las partículas y su movilidad. La temperatura y la presión son aquellos factores que que afectan cómo se agrupan las partículas y cómo interactúan entre sí. Si hay alteraciones importantes en variables de temperatura y presión se producen cambios de un estado material a otro.
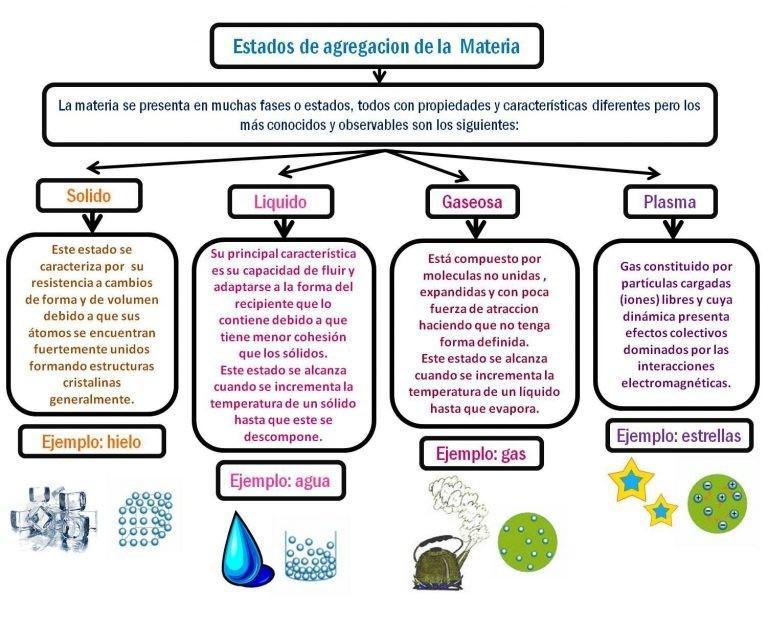
Estados sólido

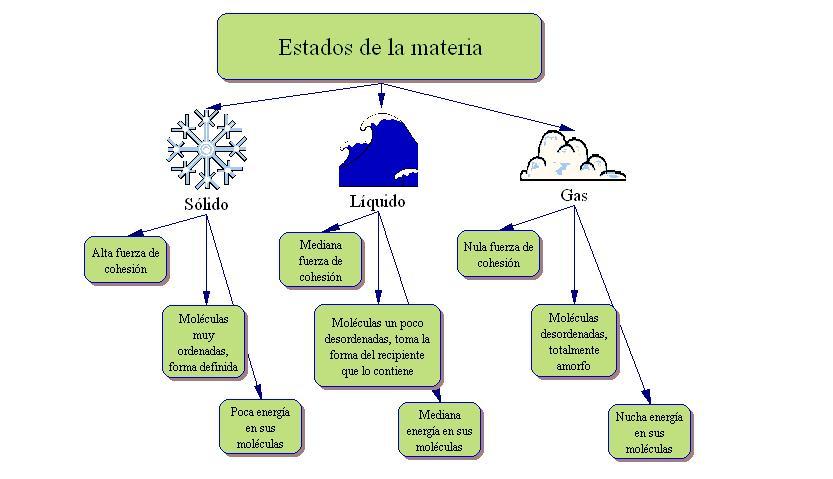
El estado sólido es aquel percibido como materia fija, una que se resiste a los cambios de forma y volumen. En la materia en estado sólido las partículas tienen mayor atracción entre ellas, lo que reduce movimiento e interacción. Por ejemplo, rocas, ciertos metales, madera, hielo, entre otros.
Estado gaseoso

El estado gaseoso es aquel de los gases. Técnicamente se define como el agrupamiento de partículas con poca atracción entre sí. que al chocar unas con otras, se expande en el espacio. Ejemplos básicos son el vapor del agua o el gas natural.
Las partículas aquí están menos concentradas que el sólido y que el líquido; no tiene forma ni volumen definido; y son sumamente dinámicas.
Estado líquido

El estado líquido se refiere a materia fluida, cuyo volumen es constante, pero se adapta a la forma del contenedor. Por ejemplo, el agua, aceite y la misma saliva que segregamos son ejemplos de materia en estado líquido.
Aquí las partículas se atraen entre sí, pero la distancia es mayor que en el caso de los sólidos. Hay un volumen constante, pero las partículas son más dinámicas que en el caso de un sólido y su forma es indefinida, de ahí que tome la del contenedor.
Estado plasmático

Este es un estado bastante más actual, descubierto en una época de mayor avance tecnológico: habría sido denominado como tal en 1920, por el Nobel de Química, Irving Langmuir. Es semejante a un estado gaseoso, pero posee partículas ionizadas, es decir, que están cargadas eléctricamente. Podríamos decir que son gases calientes.
Quizás la tardanza de su descubrimiento se deba que es sumamente recurrente este estado de la materia en los fenómenos siderales: por ejemplo hay plasma en el sol, en las estrellas y hasta en las nebulosas. Sin embargo, existen fenómenos terrestres que lo presentan: rayos, auroras polares e incluso, como fenómeno artificial creado por el ser humano, en lámparas y tubos.
Un rasgo notorio de este estado de la materia es que forma filamentos, capas y rayos cuando se expone en un campo magnético. Esto se observan muchísimas imágenes del estado plasmático.
Nuevos estados de materia
Estos estados son actuales y se han obtenido mediante procedimientos técnicos en laboratorios. Naturalmente, con el paso del tiempo pueden aparecer muchos más.
- Condensado de Bose- Einstein: Este estado se produce cuando ciertos gases son sometidos a temperaturas cercanas al cero absoluto (-273.15°C). Es tanta la densidad y el punto de congelación que los átomos no se pueden mover. Se lo conoce como el quinto estado de la materia y se lo pudo observar de manera artificial en 1995. Aquí las partículas son bosones, así que solo se lo puede vislumbrar en estado subatómico. Un ejemplo de este estado nos lo dan los materiales con superconductividad.
- Condensado de Fermi: En el condensado fermiónico la materia es superfluida, es decir, no tiene ningún grado de viscosidad. El comportamiento de este estado es similar a una onda y no a una partícula. Aquí hablamos de un estado con estabilidad corta (dura poco), producido en temperaturas cercanas al cero absoluto y sus partículas son fermiones.
- Supersólido: En este estado de la materia hay un ordenamiento en el espacio con las propiedades de un superfluido. Todavía se encuentra en investigación, porque las pruebas claras de su existencia son del 2017.
Cambios en los estados de la materia

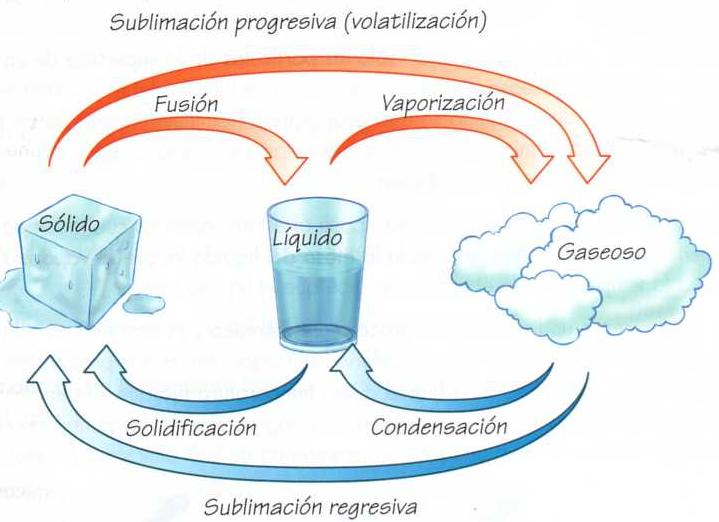
Los cambios de la materia son aquellos procesos en donde hay una modificación de un estado a otro. Depende tanto de las condiciones del ambiente, como aquellas que pueda inducir artificialmente el ser humano en un laboratorio. Si tomamos solo los estados fundamentales de la materia mencionado los cambios serían los siguientes: fusión, sublimación, sublimación inversa, ionización, desionización, vaporización y solidificación.
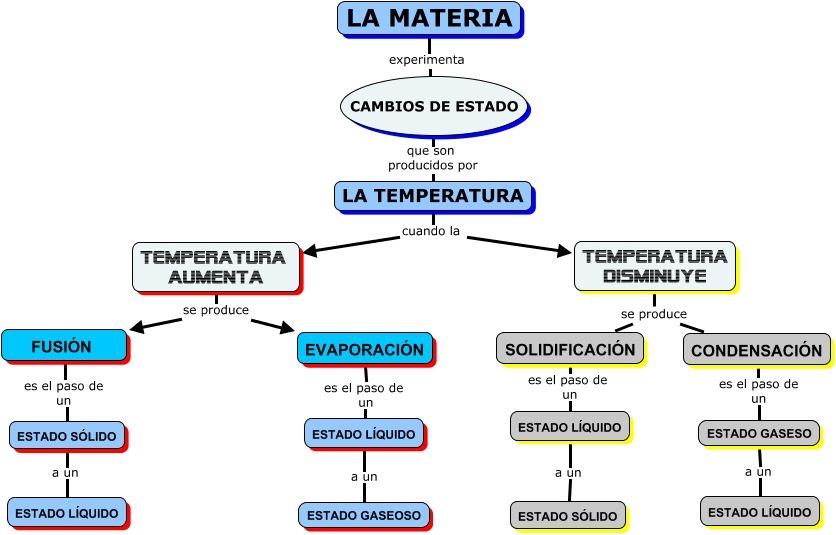
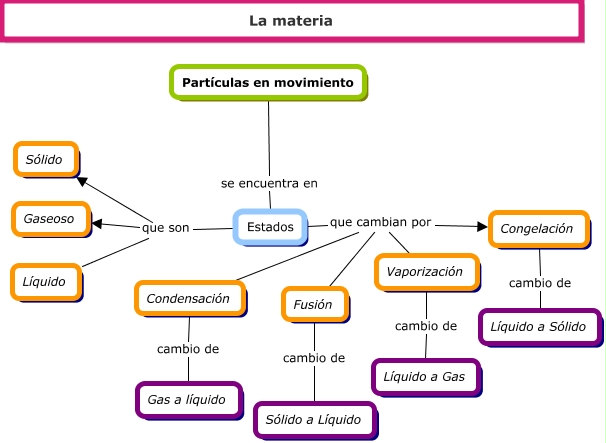
Solidificación: La solidificación es el cambio del estado líquido al sólido. Si la temperatura de un líquido desciende las partículas se aproximan entre sí y se reduce su movimiento. Cuando llegan a un punto de congelación se convierten en materia sólida.
Fusión o derretimiento: Este es el cambio del estado sólido al líquido. Se produce cuando el sólido se expone a temperaturas elevadas hasta derretirse. Esto ocurre porque las altas temperaturas hacen que las partículas se separen y sean más dinámicas.
Vaporización: La vaporización es el cambio del estado líquido al estado gaseoso. Si elevamos más la temperatura se rompe la interacción entre las partículas. Esto ocasiona su separación y aumento de movimiento, dando lugar al gas.
Condensación: La condensación es el pasaje del estado gaseoso al líquido. Al bajar la temperatura y subir la presión las partículas de gas pierden movilidad y se aproximan entre sí. Eso es lo que explica el paso de lo gaseoso a lo líquido.
Sublimación: Este es el cambio del estado sólido al gaseoso sin pasar por el estado líquido. Un buen ejemplo de ellas son las esferas de naftalina que alejan las polillas, porque desaparecen luego de su uso.
Sublimación inversa: Aquí encontramos el pasaje del estado gaseoso al sólido de manera directa, aunque también se lo puede denominar cristalización o deposición.
Ionización: La ionización produce el cambio del estado gaseoso al plasmático, lo cual se produce cuando las partículas de gas se cargan eléctricamente, algo posible cuando se calienta el gas.
Desionización: La desionizaición consiste en el paso del estado plasmático al gaseoso. Es un proceso contrario al de la ionización.
Cuadros sinópticos sobre los estados de la materia
A continuación disponemos de cuadros sinópticos para una mayor comprensión de los estados de la materia, focalizando en aquellos que se consideran clásicos.