La definición de ácidos y bases ha ido evolucionando con el tiempo y científicos como Arrhenius, Brönsted, Lowry y Lewis han ido sacando sus conclusiones a lo largo de la historia. Hoy en este blog te contaremos información sobre lo que pensaba cada uno de estos científicos en relación a los ácidos y bases. Tambien te mostraremos cuadros comparativos para que puedas comprender mejor la información.
¿Qué son los ácidos y bases?
Las sustancias con un pH de menos de 7 son ácidos. Cuanto más fuerte es el ácido, menor es el número de pH. Los ácidos convierten el papel de tornasol azul en rojo. Convierten el indicador universal en rojo si son fuertes y naranja o amarillo si son débiles. Los ácidos cuando reaccionan con algunos metales desprenden hidrogeno y conducen la corriente electrica.
Las sustancias que pueden reaccionar con los ácidos y neutralizarlos para formar una sal y agua se llaman bases. Por lo general, son óxidos metálicos o hidróxidos metálicos. Por ejemplo, el óxido de cobre y el hidróxido de sodio son bases.
Teoria de Arrhenius
Esta teoría introducida en 1887 por el científico sueco Svante Arrhenius establece que los ácidos son sustancias que se disocian en el agua para producir átomos o moléculas con carga eléctrica, llamados iones, uno de los cuales es un ion hidrógeno (H +) y que ionizan agua para producir iones de hidróxido (OH-). Ahora se sabe que el ion de hidrógeno no puede existir solo en solución acuosa; más bien, existe en un estado combinado con una molécula de agua, como el ion hidronio (H3O +). En la práctica, el ion hidronio todavía se conoce habitualmente como ion hidrógeno.
Teoria de Brönsted – Lowry
Esta teoría de Brønsted-Lowry, también llamada teoría de protones de ácidos y bases, es una teoría, introducida independientemente en 1923 por el químico danés Johannes Nicolaus Brønsted y el químico inglés Thomas Martin Lowry. Esta teoría indica que cualquier compuesto que pueda transferir un protón a cualquier otro compuesto es un ácido, y el compuesto que acepta el protón es una base. Un protón es una partícula nuclear con una carga eléctrica positiva unitaria; está representado por el símbolo H + porque constituye el núcleo de un átomo de hidrógeno.
Teoria de Lewis
La teoría de Brønsted define a los ácidos y bases como donantes de protones y receptores. Casi al mismo tiempo que Johannes N. Brønsted y Thomas M. Lowry propusieron su teoría de los ácidos y las bases, Gilbert N. Lewis propuso su propia teoría. Mientras que la teoría de Brønsted-Lowry se basa en la transferencia de protones, la teoría de Lewis se basa en la transferencia de electrones. Un ácido de Lewis es una sustancia que puede aceptar un par de electrones para formar un nuevo enlace. Para Lewis las bases son una sustancia que puede donar un par de electrones para formar un nuevo enlace. La neutralización es el intercambio de un par de electrones entre un ácido y una base. El producto formado en una reacción de neutralización a veces se denomina aducto o complejo.
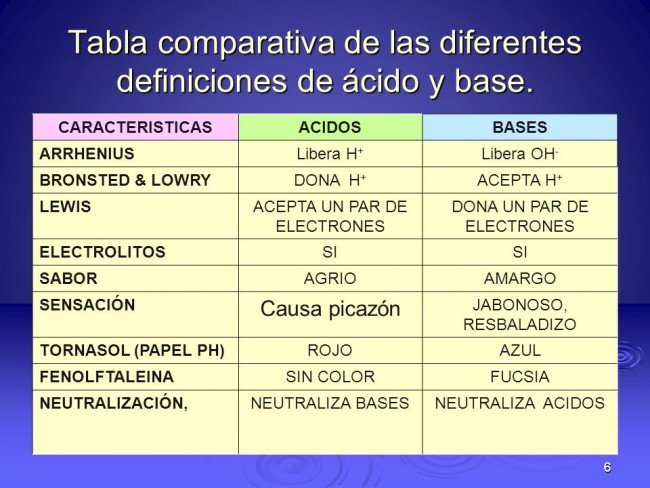
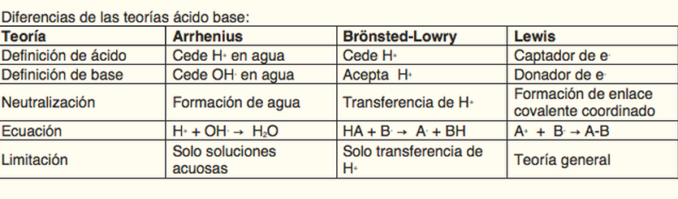
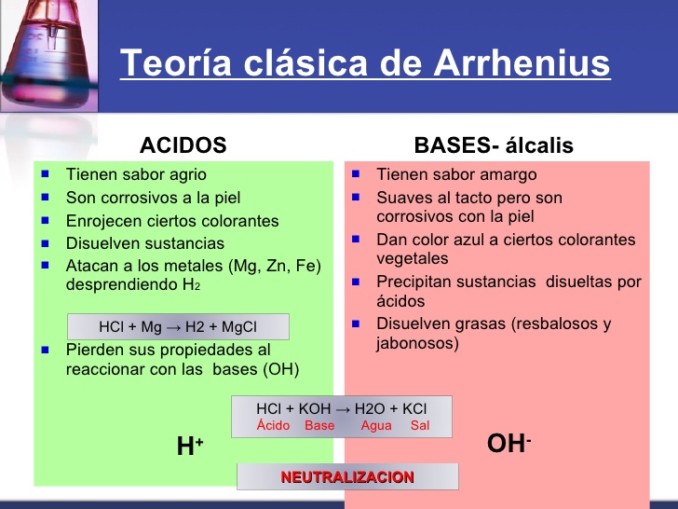
Cuadros comparativos de Arrhenius, Brönsted, Lowry y Lewis
Aquí te dejamos una selección de los mejores cuadros comparativos de las teorías de Arrhenius, Brönsted, Lowry y Lewis, para que puedas compararlas y puedas comprender cada una de ellas.


No olvides dejar tu comentario acerca de las imágenes y de toda la información que te damos aquí…